| wcg112233 | 2020-06-16 11:13 |
|
果蝇(研究最广泛的是黑腹果蝇)是生物学研究中最重要的模式生物之一。20世纪初,Morgan选择黑腹果蝇作为研究对象,通过简单的杂交及子代表型计数的方法,建立了孟德尔遗传定律,奠定经典遗传学的基础,并开创利用果蝇作为模式生物的先河。 2017年10月2日,美国遗传学家杰弗里·霍尔(Jeffrey C. Hall)、迈克尔·罗斯巴什(Michael Rosbash)和迈克尔·杨(Michael W. Young),因为利用果蝇作为模式动物发现了控制生物钟的分子机制,而获得2017年诺贝尔生理学或医学奖。一种飞舞在烂水果上的小虫子——果蝇,再一次成为成为人们关注的焦点。  图1:果蝇(来源图虫创意) 一个世纪以来,人们对果蝇在生命科学各层次的研究中积累了十分丰富的资料,对其遗传背景有了更加全面深入的了解,迄今为止,科学家们致力于利用果蝇作为模式生物全面开发生命的秘密,有关衰老、心血管疾病研究方兴未艾。2020年6月10日,来自加拿大爱荷华州立大学等机构的科学家们,在《Nature Communication》上发表了题为“Impaired peroxisomal import in Drosophila oenocytes causes cardiac dysfunction by inducing upd3 as a peroxikine(在果蝇绛色细胞中过氧化物酶体输入过程受损,可诱导upd3作为过氧化物因子而导致心脏功能障碍)“,通过对果蝇的心脏健康进行研究后发现,肝脏功能异常或会导致心脏功能恶化[1]。这项研究或能填补科学家们理解心脏健康和机体其它组织之间关联的空白,同时还能帮助开发治疗多种人类疾病的新型疗法。  图2: https://doi.org/10.1038/s41467-020-16781-w 研究背景 衰老是心血管疾病的主要危险因素之一(CVD)[2]。在衰老的过程总,心肌细胞将经历各个阶段的细胞内重塑,如线粒体损伤、活性氧(ROS)释放增加和炎症表型分泌升高等等。慢性、全身性的低水平炎症是衰老的主要生理特征之一,同时也是导致心脏功能障碍的危险因素。肝脏是主要的内分泌器官,发生感染或肝脏损伤可产生大量促炎性细胞因子,因此,肝功能不全(例如肝硬化)患者通常显示出心律不齐的增加。肝脏也富含过氧化物酶体(ROS代谢的关键细胞器),有研究表明,过氧化物酶体基因在衰老果蝇的绛色细胞中表达下调,然而,过氧化物酶体在衰老调节中的作用尚不清楚。 研究目的 该研究的作者们致力于发现在果蝇衰老过程中,肝脏细胞与心肌细胞之间由过氧化物酶体介导的器官之间的细胞关联;同时,也致力于研究促炎因子的释放与老年血管细胞中的ROS升高和心律不齐之间的关系。 研究结果 1、果蝇绛色细胞中的ROS稳态参与调节心脏功能 绛色细胞是昆虫体内一种由皮细胞转化而来的细胞,相当于人体中的肝细胞,与代谢有关。绛色细胞的作用很多,如分泌激素,参入脱皮,卵巢的发育等等。ROS稳态的破坏是衰老的标志之一。研究人员首先发现,果蝇绛色细胞中ROS稳态的破坏可通过未知的非自主机制,来调节心律。为了进一步确定这一种非自主调节机制,研究人员首先使用百草枯(PQ)喂养,诱导果蝇体内ROS高水平释放,发现PQ喂养可引起果蝇心律不齐;然而,进一步诱导果蝇绛色细胞中过氧化酶体基因(Sod1)的过表达,这种心脏功能的负性调节就被平衡了,然而在果蝇等其他的细胞中诱导Sod1的过表达将不会产生相同的效果。因此,研究人员从该部分数据得出,衰老和PQ诱导的氧化应激期间,果蝇绛色细胞在维持心脏健康中起着特定而关键的作用(图3)。  图3: ROS动态平衡通过非自主机制调节心脏功能 2、促炎因子upd3通过JAK-STAT途径参与衰老和PQ引起的心律不齐 为了确定绛色细胞是否参与了某种细胞因子的表达并在衰老以及氧化应激过程中参与各器官与心脏之间的信号传递而调节心脏功能这一机制。研究人员通过生物信息分析及筛选,发现了果蝇体内4个候选基因,分别为PGRP-SB1、Ag5r2、TotA以及upd3。进一步研究发现,绛色细胞中PGRP-SB1和upd3的敲除阻滞了由PQ引起的心律失常,而upd3是一种类IL-6的促炎因子。在果蝇中,upd3是激活JAK/STAT信号通路的三种配体之一。有趣的是,在正常衰老过程中,绛色细胞中upd3的表达急剧增加(超过52倍),并成为果蝇体内upd3产生的主要来源。这些结果表明,upd3是从绛色细胞分泌的主要细胞因子,以调节衰老和应激引起的心律不齐(图4)。 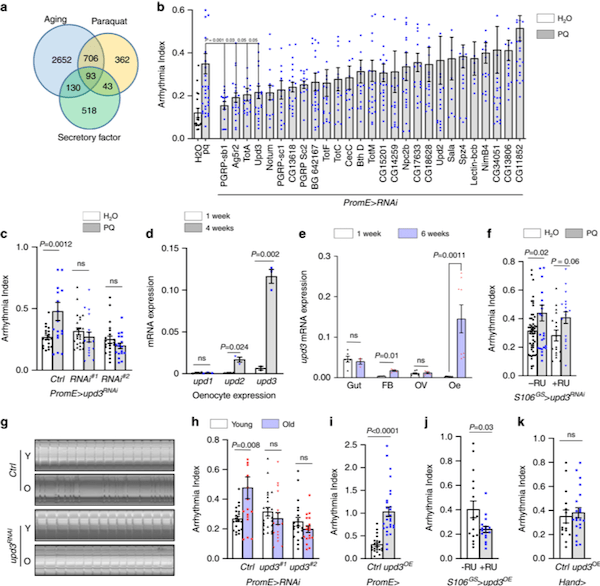 图4: 促炎性upd3介导心律不齐 3、绛色细胞中过氧化物酶体输入过程受损可诱导upd3分泌以及心律不齐的发生 研究人员认为,不同的过氧化物对ROS代谢的不同,可能可解释了它们在心律不齐和绛色细胞与心脏的信息传递中的不同作用。研究发现,过氧化物酶Prx5的敲除可诱发了心律不齐,然而敲除Dhap-at、ADPS、Acox57D-d以及Acox57D-p却没有相同的作用;同时研究发现,过氧化物酶体在绛色细胞中的导入受损将促进upd3表达。如预期的那样,绛色中Pex5或Pex1的敲除诱导了upd3的mRNA水平;绛色细胞中的Pex5敲除可以远程调节心脏的JAK/STAT信号通路活性。因此,这些研究结果表明,过氧化物酶体导入受损促进了绛色细胞中upd3的产生,并且非自主地诱发了心脏JAK/STAT信号通路转导以及心律不齐的发生(图5)。 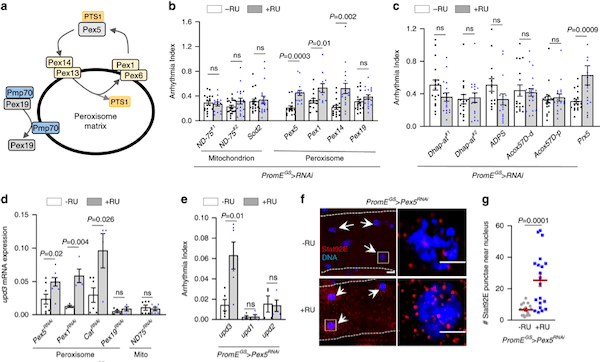 图5: 绛色细胞中过氧化物酶体的导入受损会诱导upd3并促进心律不齐 4、过氧化物酶体的导入功能在衰老的绛色细胞中受损,Pex5激活减轻衰老中的过氧化物酶体的导入功能受损以及心律不齐发生 为了监测绛色细胞衰老过程中的过氧化物酶体的导入,研究人员首先使用抗SKL抗体进行免疫染色,该抗体识别包含过氧化物酶体靶向序列(PTS)以及SKL三肽序列的过氧化物酶体基质蛋白。实验发现在衰老的绛色细胞中SKL阳性点的数目显着减少,这表明内源性过氧化物酶体基质蛋白的输注在衰老的绛色细胞中受损。 接下来,研究人员使用dCas9-VPR系统诱导了绛色细胞中的Pex5转录,使其表达高于正常水平的两倍。有趣的是,Pex5的过表达减弱了衰老的绛色细胞中与年龄相关的upd3诱导。Pex5的过表达还恢复了衰老的绛色细胞中的过氧化物酶体输入功能,抗SKL免疫染色(功能性过氧化物酶体)的数量较之前回复和过氧化物酶体空壳(非功能性过氧化物酶体)的百分比依旧较低。因此,这些研究提供了有力的证据,表明与年龄有关的过氧化物酶体输入障碍是参与衰老过程的一个未被阐明的原因(图6)。 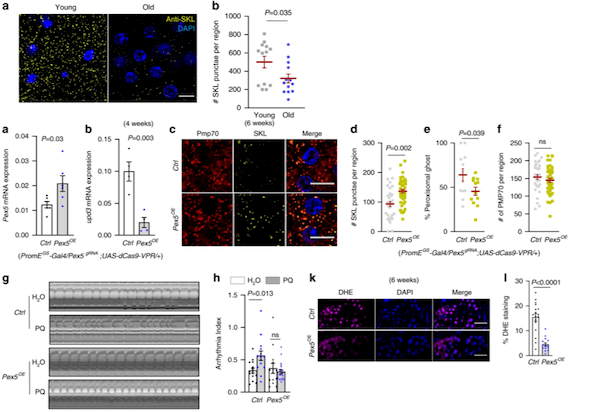 图6: 绛色细胞的Pex5激活减轻衰老中的过氧化物酶体的导入功能受损以及心律不齐发生 小结 这项研究提供了直接的证据,将卵母细胞/肝脏功能障碍与心脏健康联系起来,同时证明了老年人过氧化物酶体导入受损是促炎因子释放的主要原因,而维持过氧化物酶体导入会减缓组织衰老。 本片文章的第一作者Kerui Huang表示:“本文研究结果表明,我们可以在并不直接干预心脏组织的前体下来保护老年动物的肝脏功能并维持其心脏的健康;目前研究人员进行的大部分遗传工作都集中在对过氧化物酶体的研究上,过氧化物酶体是细胞内的关键细胞器,可调节关键的脂质代谢过程,同时对大脑和肝脏功能非常重要的解读作用。“目前尚不清楚在老年动物机体中过氧化物酶体的功能是如何改变的,而他们发现,老年果蝇的过氧化物媒体蛋白的输入功能会明显受损,诸如此类研究或能帮助科学家们深入解析过氧化物酶体调节组织老化的分子机制。 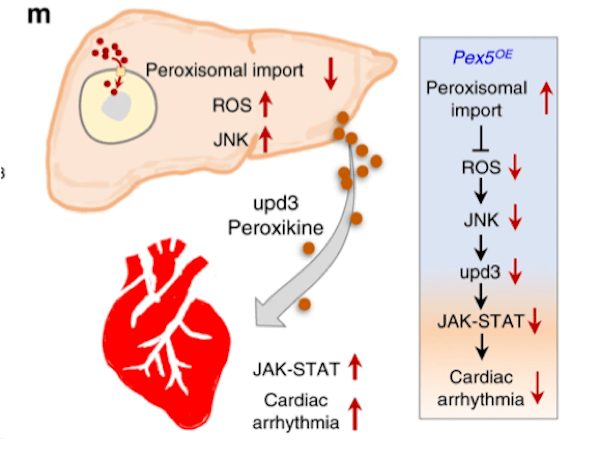 图7: 小结——在果蝇绛色细胞中过氧化物酶体输入过程受损,可诱导upd3作为过氧化物因子而导致心脏功能障碍 尽管果蝇与人类有很大的不同,但人类医学仍然可以从对果蝇的生物特性研究中获得很多信息,比如,果蝇的肝脏和心脏与人类的肝脏和心脏就拥有许多相似的功能;目前很多制药公司都非常热衷于寻找新方法来治疗年龄相关的疾病,未来研究人员还将深入研究过氧化物酶体、肝脏功能和心脏老化之间的关联,从而帮助开发更多新型治疗性药物或手段 |
|